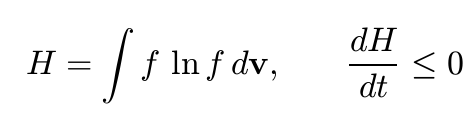Classifichiamo le trasformazioni irreversibili
Ciao, ho ritrovato il bellissimo testo “Calore e Termodinamica” di Zemansky ed elenco di seguito i processi che presentano irreversibilità di vario tipo.
Irreversibilità meccanica esterna in condizioni isoterme
Il sistema non cambia il proprio stato termodinamico (da cui sia “DeltaU = 0” che “DeltaS = 0”, con “U” energia interna e “S” entropia) e interagisce isotermicamente con un serbatoio (visto come una porzione dell’ambiente che non modifica mai la propria temperatura “T”) scambiando energia “W” in modalità lavoro (e siccome “DeltaU = 0” del sistema allora l’ambiente riceve energia “Q” pari a “W = Q”) e modificando in tal modo l’energia interna del serbatoio stesso e aumentandone l’entropia di un valore “Q / T”.
Applicazioni sono il moto irregolare di agitazione di un liquido viscoso, l’arresto di un liquido in vibrazione o rotazione, la deformazione anelastica di un solido, il passaggio di elettricità attraverso un resistore, l’isteresi magnetica di un materiale.
Irreversibilità meccanica esterna in condizioni adiabatiche
Il sistema interagisce con l’ambiente e dissipa adiabaticamente (“Q = 0”, quindi l’ambiente non cambia la propria entropia) l’energia “W” scambiata in modalità lavoro (si dice che l’ambiente “compie lavoro” sul sistema), aumentando la propria energia interna “U”. Se la trasformazione viene sostituita da una reversibile e isobara (con capacità termica “C”) che congiunga gli stessi stati allora il sistema aumenta la propria temperatura da “Ti” a “Tf” e la propria entropia “DeltaS = C log(Tf / Ti)” (per definizione di entropia di Clausius e per legge fondamentale della calorimetria e per integrazione di “C / T” in “dT”).
Applicazioni sono le stesse del caso precedente, ma in condizioni di isolamento termico.
Irreversibilità meccanica interna
Il sistema trasforma la propria energia interna in energia meccanica, la quale poi si trasforma nuovamente in energia interna, senza modificare lo stato dell’ambiente (che non cambia dunque la propria entropia).
Applicazioni sono l’espansione libera di un gas perfetto nel vuoto (vedi anche #qui), l’espansione strozzata di un gas che filtra attraverso un setto poroso, la rottura di un filo in tensione quando viene tagliato, lo scoppio di una bolla di sapone quando viene forata.
Irreversibilità termica esterna
Il sistema scambia energia “Q” in modalità calore, con l’ambiente, ma tali parti dell’universo termodinamico non si trovano in equilibrio termico tra loro, durante tale scambio.
Applicazioni sono la conduzione o radiazione di energia in modalità calore da un sistema all’ambiente circostante più freddo, la conduzione o radiazione del calore attraverso un sistema (il cui stato non cambia ed è dunque stazionario) da un serbatoio caldo “1” ad uno più freddo “2” (L’universo presenta un aumento di entropia pari a “Q / T2 – Q / T1”).
Irreversibilità chimica
Se nell’universo termodinamico abbiamo una variazione spontanea di struttura interna, composizione chimica, densità e altre grandezze caratteristiche.
Applicazioni sono le reazioni chimiche, la diffusione di due gas ideali inerti differenti (se abbiamo una mole di ogni gas che raddoppia il proprio volume, allora considerando due espansioni libere troviamo che l’universo aumenta la propria entropia di un valore “2R log2”, con “R” costante dei gas perfetti), una miscela di alcool e acqua, il congelamento di un liquido soprafuso, la condensazione di un vapor soprasaturo, la soluzione di un solido in acqua, l’osmosi.