Sia dato un gas ideale molto rarefatto in uno stato di non-equilibrio termico, cioè un sistema di moltissime particelle debolmente interagenti che si muovono in modo caotico e che non presentano inizialmente una distribuzione delle velocità uguale a quella di equilibrio. Se questo sistema isolato viene lasciato evolvere l’equazione di stato prevede che dopo un certo tempo verrà raggiunto l’equilibrio la cui temperatura è legata ai valori di pressione, volume e numero di moli del gas stesso. Dal punto di vista microscopico avremo che la distribuzione iniziale delle velocità raggiungerà quella di Maxwell-Boltzmann e rimarrà tale nei tempi successivi.
Se definiamo l’entropia del gas allo stato iniziale come la somma delle entropie di equilibrio di numerosi sottosistemi in equilibrio locale, essa sarà sempre minore dell’entropia nello stato di equilibrio finale, grazie al secondo principio della termodinamica riformulato in chiave moderna da De Groot e Mazur. Analogamente in virtù del teorema H di Boltzmann esiste un funzionale che diminuisce nel tempo sotto ipotesi di caos molecolare e tale funzionale all’equilibrio è proporzionale all’opposto dell’entropia.
Ora sorge una domanda: come possiamo definire con precisione le ipotesi di caos molecolare? Sono ingredienti essenziali per giustificare l’emergenza della freccia del tempo dall’approccio microscopico a quello macroscopico, quindi non possiamo mantenere nel vago la definizione di caos molecolare.
– Boltzmann nel 1872 scrive: “Vogliamo accettare solo due limitazioni che stanno nella natura delle cose. E’ ben chiaro che, dopo il trascorrere di un tempo molto lungo, per la direzione di ogni molecola ogni direzione nello spazio sarà ugualmente probabile. Se perciò si tratta semplicemente di trovare la distribuzione delle velocità prodotta dopo un lungo tempo, possiamo assumere che già dall’inizio ogni direzione sia stata equiprobabile. Si può ridurre il caso più generale a nessun’altra distribuzione di stato che questa specifica. Sia questa la prima limitazione che vogliamo porre. La seconda sia che la distribuzione di velocità sia uniforme [nello spazio] già dall’inizio […] [per cui ad esempio] non vi sono a destra [particelle] più veloci e a sinistra più lente […]. E’ chiaro che entrambe le condizioni saranno soddisfatte anche per tutto il tempo, ossia che lo stato del gas al tempo t è completamente determinato dalla funzione f(x,t) “.
Boltzmann si riferisce a “f” per indicare la distribuzione e a “x” per indicare l’energia cinetica di singola particella (da cui si può ricavare la velocità, ovviamente) e ricava una equazione integro-differenziale e non lineare che permette di calcolare f(x,t) a partire da f(x,0). Le uniche responsabili della variazione della distribuzione sono le collisioni, dovute a forze centrali e dipendenti dalla sola distanza reciproca tra due particelle. In merito a tali interazioni Boltzmann definisce una funzione ”  ” che in virtù dell’ipotesi sul numero di collisione (Stosszahlansatz) soddisfa questa regola (x e x’ indicano le energie cinetiche prima della collisione, mentre
” che in virtù dell’ipotesi sul numero di collisione (Stosszahlansatz) soddisfa questa regola (x e x’ indicano le energie cinetiche prima della collisione, mentre  indica l’energia cinetica della prima particella dopo la collisione):
indica l’energia cinetica della prima particella dopo la collisione): %3D%5Csqrt%7B%5Cxi(x%2Bx'-%5Cxi)%7D%5Cpsi(%5Cxi%2Cx-x'-%5Cxi%2Cx)) . E’ cruciale affermare che senza questa ipotesi non potremmo avere l’equazione di Boltzmann nella forma utilizzata da lui stesso nel teorema H e dunque non potremmo dimostrare che “H(t)” diminuisce nel tempo al variare della distribuzione “f(x,t)” fino a raggiungere la distribuzione di equilibrio, per poi rimanere costante nel tempo.
. E’ cruciale affermare che senza questa ipotesi non potremmo avere l’equazione di Boltzmann nella forma utilizzata da lui stesso nel teorema H e dunque non potremmo dimostrare che “H(t)” diminuisce nel tempo al variare della distribuzione “f(x,t)” fino a raggiungere la distribuzione di equilibrio, per poi rimanere costante nel tempo.
– Huang nel 1963 definisce una funzione di correlazione “F” e afferma, sulla linea di lavoro di Boltzmann, che “gli impulsi di due particelle nell’elemento di volume sono scorrelati, in tal modo la probabilità di trovarli simultaneamente è uguale al prodotto delle probabilità di trovarli singolarmente. Questa è conosciuta come l’assunzione del caos molecolare”.
Tuttavia viene fatto un passo avanti: “L’evoluzione nel tempo di H è determinata dalla evoluzione nel tempo della distribuzione f, che in generale non soddisfa l’equazione del trasporto di Boltzmann. Essa soddisfa tale equazione solo nell’istante in cui diventa valida l’assunzione di caos molecolare. Il teorema H afferma che se ad un dato istante  lo stato del gas soddisfa l’assunzione del caos molecolare, allora all’istante
lo stato del gas soddisfa l’assunzione del caos molecolare, allora all’istante  (con incremento tendente a zero) o
(con incremento tendente a zero) o  oppure
oppure  ma solo nel caso in cui la distribuzione sia quella di Maxwell-Boltzmann […]. [L’assunzione di caos molecolare] non ha niente a che vedere con la forma della funzione di distribuzione, cosicché uno stato del gas con una certa funzione di distribuzione può oppure no soddisfare l’assunzione del caos molecolare”.
ma solo nel caso in cui la distribuzione sia quella di Maxwell-Boltzmann […]. [L’assunzione di caos molecolare] non ha niente a che vedere con la forma della funzione di distribuzione, cosicché uno stato del gas con una certa funzione di distribuzione può oppure no soddisfare l’assunzione del caos molecolare”.
Huang poi dimostra (utilizzando l’invarianza temporale delle equazioni del moto) che quando il gas è in uno stato di caos molecolare allora H è in un picco locale e giunge a riformulare il teorema H in questo modo: “se adesso c’è caos molecolare, allora al prossimo istante  ; se nel prossimo istante ci sarà caos molecolare, allora adesso vale
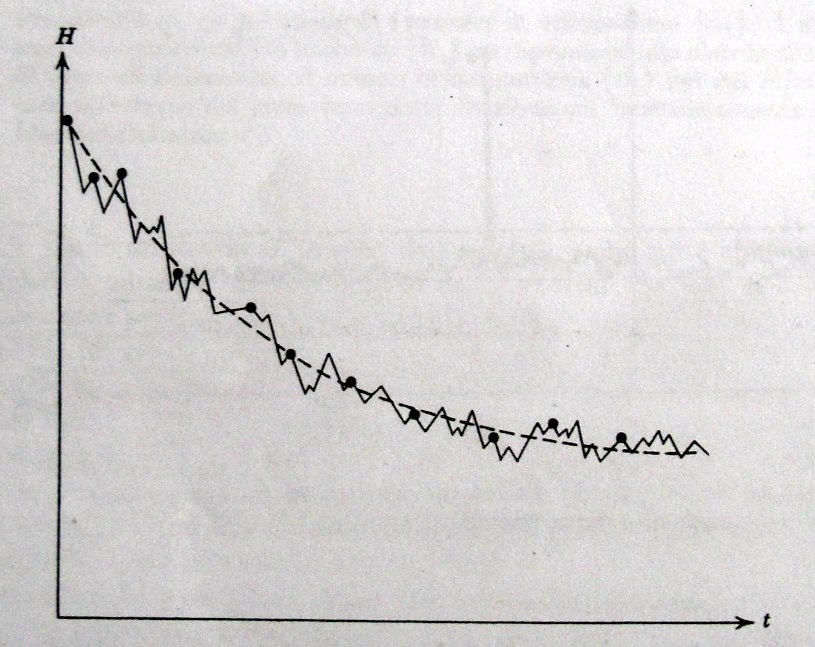
; se nel prossimo istante ci sarà caos molecolare, allora adesso vale  “. Viene dunque affermato che la funzione “derivata di H rispetto al tempo” non è necessariamente una funzione continua nel tempo, potendo cambiare improvvisamente per gli urti molecolari. Possiamo quindi comprendere come H subisca numerose e piccole fluttuazioni nel tempo (con rarissimi casi di fluttuazioni elevate), la sequenza temporale degli stati di caos molecolare sia casuale e dunque che l’equazione del trasporto di Boltzmann sia da considerare valida in un senso statistico (come ho accennato nel mio post precedente si veda in merito il lavoro di Kac sulla costruzione – a partire dall’equazione di Boltzmann – di una master equation; vengono riviste le ipotesi di caos molecolare utilizzando un approccio probabilistico). Possiamo infine immaginarci il “tendere all’equilibrio” con il seguente grafico, proposto dallo stesso Huang.
“. Viene dunque affermato che la funzione “derivata di H rispetto al tempo” non è necessariamente una funzione continua nel tempo, potendo cambiare improvvisamente per gli urti molecolari. Possiamo quindi comprendere come H subisca numerose e piccole fluttuazioni nel tempo (con rarissimi casi di fluttuazioni elevate), la sequenza temporale degli stati di caos molecolare sia casuale e dunque che l’equazione del trasporto di Boltzmann sia da considerare valida in un senso statistico (come ho accennato nel mio post precedente si veda in merito il lavoro di Kac sulla costruzione – a partire dall’equazione di Boltzmann – di una master equation; vengono riviste le ipotesi di caos molecolare utilizzando un approccio probabilistico). Possiamo infine immaginarci il “tendere all’equilibrio” con il seguente grafico, proposto dallo stesso Huang.